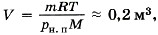
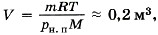
Пример 1. Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С 6 Н 12 О 6 при 0°С.
Решение: Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
π oc м = nRT / V ,
где п - количество растворенного вещества, моль;
V – объем раствора, м 3 ;
R - молярная газовая постоянная, равная 8,3144 Дж/(моль-К).
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
Пример 2. Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙10 5 Па при 20°С.
Решение: Заменив п выражением m / M , где т - масса растворенного вещества, а М - его молярная масса, получим
π oc м = mRT /(MV ).
Отсюда молярная масса растворенного вещества равна
Следовательно, молекулярная масса неэлектролита равна 52,96.
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм. атм.: R=0,082 л∙атм../град.∙моль;
Вычислите осмотическое давление раствора, содержащего 90,08 г глюкозы С 6 H 12 O 6 в 4 л раствора при 27 0 С. Ответ: 3,12∙10 5 Па.
Найдите осмотическое давление при 0 0 С для раствора, содержащего в 1 л 18,4 г глицерина С 3 Н 8 О 3 . Ответ: 4,54∙10 5 Па.
Рассчитайте осмотическое давление раствора неэлектролита, содержащего 1,52∙10 23 молекул в 0,5л раствора при 0 и при 30 0 С.
Ответ: 11,35∙10 5 Па; 12,60∙10 5 Па.
В 1 л раствора при 25°С содержится 6,84 г сахара C 12 H 22 O 11 и 1/38 г этилового спирта С 2 Н 5 ОН. Каково осмотическое давление раствора? Ответ:12,39∙10 4 Па.
При 0°С осмотическое давление раствора сахара C 12 H 22 O 11 и равно 3,55∙10 5 Па. Сколько граммов сахара содержится в 1 л раствора? Ответ:53,53г.
Осмотическое давление раствора, содержащего в 1л 3,2г неэлектролита, равно 2,42∙10 5 Па при 20 0 С. Вычислите молекулярную массу неэлектролита. Ответ: 32,2.
В 0,5л раствора содержится 2г неэлектролита, и раствор при 0 0 С имеет осмотическое давление, равное 0,51∙10 5 Па. Какова молекулярная масса неэлектролита? Ответ: 178.
Найдите формулу вещества (маннита), содержащего 39,56% углерода, 7,69% водорода и 52,75% кислорода, если осмотическое давление раствора, содержащего в 1л 72 г маннита, равно 9,00∙10 5 Па при 0 0 С. Ответ: С 6 H 14 O 6 .
Раствор анилина С 6 H 5 NH 2 имеет такое же осмотическое давление, что и раствор, содержащий 3,2 г СН 3 ОН в 1 л воды при 18 0 С. Сколько граммов анилина содержится в 1 л раствора? Ответ: 9,30 г.
При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С 6 Н 12 О 6 , достигнет 607,8 кПа? Ответ: 19,5 0 С.
Вычислить осмотическое давление 25%-ного раствора сахара С 12 H 22 O 11 при 15 0 С (плотность 1,105 г/мл). Ответ: 1935кПа.
Сколько граммов глюкозы С 6 H 12 О 6 содержится в 200 мл раствора, осмотическое давление которого при 37 0 C составляет 810,4 кПа? Ответ: 11,3г.
Осмотическое давление раствора, в 250 мл которого содержится 0,66 мочевины, равно 111,1 кПа при 33 0 С. Вычислите молекулярную массу мочевины. Ответ: 60,3.
Сколько молекул растворенного вещества содержится в 1 мл раствора, осмотическое давление которого при 54 °С составляет 6065 Па? Ответ: 1,34∙ 10 18 .
1 мм 3 раствора содержит 10 15 молекул растворенного вещества. Вычислить осмотическое давление раствора при 0 0 С. В каком объеме раствора содержится 1 моль растворенного вещества? Ответ: 3772 Па; 602 л.
Из 342 г сахара С 12 Н 22 O 11 и воды приготовлено 22,4 л раствора. Чему равно осмотическое давление при 0 0 С?
Вычислите осмотическое давление 5%-ного раствора ацетона (СН 3) 2 СO в воде при 0 0 С. Плотность раствора 0,90 г/мл. Ответ: 19 атм.
Вычислить осмотическое давление раствора при 17 0 С, если 1 л его содержит 18,4 г глицерина С 3 Н 8 O 3 . Ответ: 4, 76 атм.
Опытным путем найдено, что осмотическое давление раствора, содержащего 5 г гемоглобина (белковое вещество крови) на 100 мл раствора, при 27 0 С равно 13,65 мм рт.ст. Вычислить молекулярную массу гемоглобина. Ответ: ~68500.
В 7 л раствора содержится 24,4 г неэлектролита. Осмотическое давление раствора при 0 0 С равно 1,3 атм. Вычислить молекулярную массу неэлектролита. Ответ: 60.
Раствор сахара С 12 H 12 О 11 при 0 0 С имеет осмотическое давление, равное 144 мм рт.ст. Сколько граммов сахара содержится в 1 л такого раствора? Ответ: 2,3 г.
Осмотическое давление раствора глюкозы С 6 Н 12 O 6 при 0 0 С равно 4,48 атм. Какова молярность такого раствора? Сколько граммов глюкозы содержит 1 л этого раствора? Ответ: 0,2 моль/л; 36г.
40 мл раствора, содержащего 0,2 г растворенного вещества, при 27,3 0 С обнаруживают осмотическое давление, равное 1,2 атм. Вычислить молекулярную массу растворенного вещества. Ответ: 102,75.
Выразить в мм рт.ст. осмотическое давление раствора при 0 0 С, содержащего 6,02∙10 17 молекул растворенного вещества в 1 мл раствора. Ответ: 680 мм рт.ст.
Выразить в мм рт.ст. осмотическое давление раствора при 10 0 С, содержащего 0,736 г глицерина С 3 Н 8 0 3 в 400 мл раствора. Ответ: 553 мм рт.ст.
Вычислить молярную концентрацию раствора, осмотическое давление которого при 0 0 С равно 1,12 атм. Ответ: 0,05 моль/л.
При 0 0 С осмотическое давление раствора, содержащего 0,550 г гидрохинона в 500 мл раствора, равно 170,2 мм рт.ст. Вычислить молекулярную массу растворенного вещества. Ответ: 110.
При 0 0 С осмотическое давление раствора, содержащего 3,04 г дифениламина в 600 мл раствора, равно 510,7 мм рт.ст. Вычислить молярную массу дифениламина. Ответ: 169.
Сколько воды надо прибавить к 5 л раствора сахара С 12 Н 22 O 11 , чтобы понизить его осмотическое давление с 10,13∙10 5 до 1,013∙10 5 Па? Ответ: 45 л.
Во сколько раз повысится осмотическое давление раствора концентрации 0,1 моль/л при нагревании от 7 до 47 0 С? Ответ: в 1,14 раза.
«Физика - 10 класс»
При решении задач надо иметь в виду, что давление и плотность насыщенного пара не зависят от его объёма, а зависят только от температуры. Уравнение состояния идеального газа приближённо применимо и для описания насыщенного пара. Но при сжатии или нагревании насыщенного пара его масса не остаётся постоянной.
При решении некоторых задач могут понадобиться значения давления насыщенного пара при некоторых температурах. Эти данные нужно брать из таблицы.
Задача 1.
Закрытый сосуд объёмом V 1 = 0,5 м 3 содержит воду массой m = 0,5 кг. Сосуд нагрели до температуры t = 147 °С. На сколько следует изменить объём сосуда, чтобы в нём содержался только насыщенный пар? Давление насыщенного пара р н. п при температуре t = 147 °С равно 4,7 10 5 Па.
Р е ш е н и е.
Насыщенный пар при давлении р н. п занимает объём, равный ![]() где М = 0,018 кг/моль - молярная масса воды. Объём сосуда V 1 > V, а значит, пар не является насыщенным. Для того чтобы пар стал насыщенным, объём сосуда следует уменьшить на
где М = 0,018 кг/моль - молярная масса воды. Объём сосуда V 1 > V, а значит, пар не является насыщенным. Для того чтобы пар стал насыщенным, объём сосуда следует уменьшить на
Задача 2.
Относительная влажность воздуха в закрытом сосуде при температуре t 1 = 5 °С равна φ 1 = 84 %, а при температуре t 2 = 22 °С равна φ 2 = 30 %. Во сколько раз давление насыщенного пара воды при температуре t 2 больше, чем при температуре t 1 ?
Р е ш е н и е.
Давление водяного пара в сосуде при Т 1 = 278 К равно ![]() где р н. п1 - давление насыщенного пара при температуре Т 1 . При температуре Т 2 = 295 К давление
где р н. п1 - давление насыщенного пара при температуре Т 1 . При температуре Т 2 = 295 К давление ![]()
Так как объём постоянен, то по закону Шарля
Отсюда ![]()
Задача 3.
В комнате объёмом 40 м 3 температура воздуха 20 °С, его относительная влажность φ 1 = 20 %. Сколько надо испарить воды, чтобы относительная влажность φ 2 достигла 50 % ? Известно, что при 20 °С давление насыщающих паров р н п = 2330 Па.
Р е ш е н и е.
Относительная влажность ![]() отсюда
отсюда
Давление пара при относительной влажности φ 1 и φ 2
Плотность связана с давлением равенством ρ = Mp/RT, откуда
Массы воды в комнате при влажности φ 1 и φ 2
Масса воды, которую надо испарить:
Задача 4.
В комнате с закрытыми окнами при температуре 15 °С относительная влажность φ = 10 %. Чему станет равна относительная влажность, если температура в комнате повысится на 10 °С? Давление насыщенного пара при 15 °С р н. п1 = 12,8 мм рт. ст., а при 25 °С р н п2 = 23,8 мм рт. ст.
Так как пар ненасыщенный, то парциальное давление пара изменяется по закону Шарля р 1 /Т 1 = р 2 /Т 2 . Из этого уравнения можно определить давление ненасыщенного пара р 2 при Т 2: р 2 = р 1 Т 2 /Т 1 . Относительная влажность при Т 1 равна:
Относительная влажность при Т 2 = 25 °С равна:
Из уравнения (1) получим следовательно, ![]()
Задача 5.
Относительная влажность воздуха в помещении 60% температура 18 °С. До какой температуры надо охладить металлический предмет, чтобы его поверхность запотела?
Р е ш е н и е.
Относительная влажность воздуха φ = (р/р н п)100%.
Для конденсации пара необходимо, чтобы он стал насыщенным, т. е. температура достигла точки росы. Давление пара при 18 °С должно стать равным давлению насыщенного пара при искомой температуре:
Давление насыщенного пара р н п = 1,23 10 4 Па при температуре t 2 = 10 °С (определяем по таблице). Следовательно, t 2 ≈ 10 °С.
Давление насыщенного пара
1. Определите давление насыщенного пара воды при 25 °С над водным раствором сахарозы, моляльность которого 0,2 , зная, что давление насыщенного пара чистой воды при 25 °С равно 3167 Па.
Ответ: Р = 3156 Па.
2. При температуре 70 °С давление насыщенного пара чистого бензола 72968 Па, чистого толуола – 26927 Па. Определите общее давление пара и парциальные давления паров, равновесных при 70 °С с жидкой смесью бензола с толуолом. Мольная доля толуола в жидкой фазе N ж (С 6 Н 5 СН 3) = 0,2.
Ответ: Р = 63759 Па, Р(С 6 Н 6) = 58374 Па, Р(С 6 Н 5 СН 3) = 5385 Па.
3. Вычислите давление насыщенного пара над 2%-ным (по массе) водным раствором сахарозы (С 12 Н 22 О 11) при 373 К. Считайте этот раствор подчиняющимся законам предельно разбавленных растворов. Давление пара чистого растворителя при 373 К Р° = 1013 гПа.
Ответ: Р = 1012 гПа.
4. При 298 К давление водяного пара составляет 23,76 Торр, а давление пара морской воды 22,98 Торр. Полагая, что морская вода из всех солей содержит только хлорид натрия, оцените моляльную концентрацию соли.
Ответ: С мл (NaCl) = 0,93 .
5. Давление пара чистой воды при 313 К равно 7375,4 Па. Вычислите при данной температуре давление пара над раствором, содержащим 0,9206×10 -2 кг глицерина в 0,36 кг воды. Формула глицерина: СН 2 ОН-СНОН-СН 2 ОН.
Ответ: Р = 7338,7 Па.
6. В 0,1 кг эфира (М = 74 ) содержится 0,01 кг нелетучего вещества. Давление пара этого раствора равно 426 Торр при 293 К, а давление пара чистого эфира при 293 К равно 442 Торр. Рассчитайте молярную массу растворённого вещества.
Ответ: М = 197,2 .
2. Понижение температуры замерзания и повышение температуры кипения
7. В водном растворе этилового спирта мольная доля спирта 0,042. Определите температуру замерзания этого раствора при Р = 1 атм.
Ответ: t з = -4,54 °С.
8. 55,16 г сахарозы растворено в 316,3 г воды. Рассчитайте точку кипения и точку замерзания этого раствора.
Ответ: Т к = 373,41 К; Т з = 272,2 К.
9. Широко применяемый антифриз для радиаторов автомобилей содержит этиленгликоль (СН 2 ОН – СН 2 ОН). Сколько этого вещества следует добавить в воду радиатора общим объёмом 7,5 л, если принять за самую низкую температуру эксплуатации –20 °С. Плотность этиленгликоля 1110 .
Ответ: m (СН 2 ОН – СН 2 ОН) = 3125 г.
10. К очень слабым водным растворам для предотвращения замерзания в зимнее время обычно прибавляют глицерин СН 2 ОН-СНОН-СН 2 ОН. Допустив, что закон Рауля применим для растворов такой концентрации, вычислите, сколько глицерина нужно прибавить, чтобы раствор, содержащий 0,1 кг воды, не замерзал до 268,16 К.
Ответ: m (СН 2 ОН-СНОН-СН 2 ОН) = 24,75 г.
11. 10 мг органического вещества растворено в 1 г камфоры. Понижение температуры замерзания камфоры составило 1,33 К; криоскопическая постоянная камфоры 40. Рассчитайте молярную массу растворённого вещества.
Ответ: М = 301 .
12. В 0,0106 кг раствора содержится 0,4×10 -3 кг салициловой кислоты, растворённой в этиловом спирте. Этот раствор кипит при температуре на 0,337 К выше температуры кипения чистого спирта. Определите молярную массу салициловой кислоты, учитывая, что эбулиоскопическая постоянная этилового спирта 1,19.
Ответ: М = 138,6 .
13. Вычислите температуру замерзания водного раствора мочевины, если её мольная доля в растворе 0,0032, а теплота плавления льда D m Н° = 6010 . Считайте раствор предельно разбавленным.
Ответ: Т з = 272,82 К.
14. Рассчитайте точку замерзания раствора, содержащего 5 г никотина С 10 Н 14 N 2 в 250 г этанола. Температура замерзания чистого этанола 156 К, а теплота плавления этанола D m Н°=5,02×10 3 .
Ответ: Т з = 155,77 К.
15. Температура кипения бензола равна 353,36 К, а теплота кипения 30795 . Рассчитайте эбулиоскопическую постоянную бензола.
Ответ: Э = 2,629.
Осмотическое давление
16. Вычислите осмотическое давление водного раствора сахарозы (С 12 Н 22 О 11) и давление насыщенного пара над раствором по следующим данным. Температура раствора 293 К; на 100г раствора приходится 6,84 г сахарозы; давление насыщенного пара чистой воды при 293 К Р°= 23,38 гПа.
Ответ: P = 487 кПа; Р = 23,3 гПа.
17. Калифорнийская секвойя – самое высокое дерево в мире. Считая, что её высота 105,4 м, оцените осмотическое давление, необходимое для подъёма воды от корней до вершины.
Ответ: P = 10,2 атм.
18. Если трубу с полупроницаемой мембраной на одном конце поместить в морскую воду на достаточную глубину, гидростатическое давление воды должно привести к обратному осмосу – пресная вода потечёт в трубу. Морская вода имеет осмотическое давление 23 атмосферы и плотность 1,03 . На какую глубину необходимо опустить трубу для обратного осмоса?
Ответ: h = 235 м.
19. 20 мг белка растворено в 10 г воды. При температуре 25 °С осмотическое давление раствора составляет 0,3 Торр. Определите молярную массу белка, считая раствор идеальным.
Ответ: М = 1,24×10 5 .
D. Растворы электролитов
Давление насыщенного водяного пара
Решение задача 127 Пользуясь таблицей давлений насыщенных водяных паров, определить давление насыщенных паров, если вода закипела при 60 °С.
Решение задача 128 Вода закипела при 160 °С. Пользуясь таблицей давлений насыщенных водяных паров, определить внешнее давление над водой.
Решение задача 129 При какой температур закипит вода если внешнее давление над поверхностью окажется равным,76 кПа? При решении задач использовать таблиц давлений насыщенных водяных паров.
Решение задача 134 Относительная влажность воздуха при 20 °С равна 58%. При какой максимальной температуре выпадет роса? Плотность насыщающего пара 17,3·10–3 кг/м3 при 20 °С.
Решение задача 135 Давление ненасыщенного водяного пара при температуре 300 К равно 1,5 кПа. Определить концентрацию молекул.
Решение задача 136 При температуре 300 K давление насыщенного водяного пара 3·104 Па. Пар отделили от жидкости и нагрели при постоянном объеме до 350 К. Определить давление пара при этой температуре.
Решение задача Масса m = 40 г сахара (С12Н22О11) растворена в объеме V = 0,5 л воды. Температура раствора t = 50 °С. Найти давление с насыщенного водяного пара над раствором.
задача Найти давление насыщенного пара над раствором при температуре 60 °С, если давление насыщенного пара над этим же раствором при температуре 30 °С равно 4,2 кПа.
задача Давление насыщенного пара над раствором меньше, чем давление насыщенного пара чистой воды в 1,02 раза. Вычислить число N молекул воды, приходящееся на одну молекулу растворенного вещества?
задача Нелетучее вещество массой 100 г растворили в воде объемом 1 л. Температура раствора 90 °С. Давление насыщенного пара над раствором этого вещества 68,8 кПа. Найти молярную массу вещества, которое растворили.
задача Нелетучее вещество, молярная масса которого μ = 60 г/моль, растворили в воде. Температура раствора 80 °C. Давление насыщенного пара над раствором 47,1 кПа. Найти осмотическое давление р0 раствора.
задача В запаянной трубке объемом V = 0,4 л находится водяной пар под давлением рп = 8,5 кПа при температуре Tп = 423 К. Сколько росы выпадает на стенках трубки при охлаждении воды до температуры Tн.п = 295 К? Давление насыщающих паров воды при температуре 295 К равно рн.п = 2,6 кПа.
Задача Влажный воздух объемом 1 м при относительной влажности φ = 60%, температуре T = 293 К и нормальном атмосферном давлении имеет массу m = 1,2004 кг. Определите давление насыщающего водяного пара при температуре Т.
задача В сосуде находится воздух, температура которого T1 = 283 К и влажность φ = 60%. Как изменится влажность воздуха и его давление, если воздух нагреть до температуры T2 = 373 К и в три раза уменьшить объем? Начальное давление сухого воздуха р1 = 38,5 кПа, давление насыщающих паров воды при 283 К равно р1н = 1,2 кПа.
задача Относительная влажность воздуха в закрытом сосуде при температуре t1 = 20°С равна φ1 = 0,3. Определить относительную влажность воздуха при температуре t2 = 8°С. При t1 давление насыщенных паров воды рн1 = 2,33 кПа, при t2 оно равно рн2 = 1,07 кПа.
задача Сухой воздух заполняет закрытый сосуд объемом V = 25 л при давлении р1 = 105 Па и температуре t1 = –23 °С. В сосуд кладут кусок льда массой т = 9 г и нагревают сосуд до температуры t2 = 127 °С. Определите давление влажного воздуха в сосуде. Давление насыщенного водяного пара при температуре t = 127 °С равно рн = 250 кПа. Молярная масса воды р = 18·10–3 кг/моль.
задача В теплоизолированном сосуде, разделенном пополам перегородкой, находится насыщенный водяной пар: в левой части - при температуре t1 = 20°С, а в правой - при t2 = 50°С. Чему будут равны плотность, температура и давление пара в сосуде, если перегородку убрать? Будет ли этот пар насыщенным?
задача При температуре = 3 °С давление насыщенного водяного пара р0 = 5,945 Па Влажный воздух при это температуре, относительно влажности φ = 8 % и давлении р = 101, кПа занимает объем = 1 м3. Определить его массу.
задача Вечером температура воздуха была t1 = 16 °С, относительная влажность 65%. Ночью температура воздуха понизилась до t2 = 4 °С. Была ли роса? При температуре 16 °С плотность насыщенного водяного пара p01 = 13,6 г/м3, а при 4 °С - p02 = 6,4 г/м3.
задача Найти абсолютную и относительную влажность воздуха в комнате при температуре t1 = 20 °С, если точка росы t2 = 9 °С. Как изменится относительная влажность при понижении температуры до t3 = 16 °С, если абсолютная влажность останется прежней? Плотности насыщенного водяного пара при температурах t1, t2 и t3 равны соответственно: p01 = 17,3·10–3 кг/м3, р02 = 8,8·10–3 кг/м3, р03 = 13,6·10–3 кг/м3.
задача Вычислить при температуре 100°С плотность насыщающего водяного пара?
задача Таблицы показывают, что если давление насыщающего пара воды выражать в мм рт. ст., а его плотность - в г/м3 то при температурах, не сильно отличающихся от комнатной, эти величины близки друг к другу. Доказать это. (Использовать решение задачи 304.)
задача Воздух имеет температуру 60°С и абсолютную влажность 50 г/м3. Какой будет абсолютная влажность этого воздуха, если температура понизится до 10°С? Известно, что при 10° С давление насыщающего пара воды равно 1230 Н/м2.
задача В комнате объемом 40 м3 воздух имеет температуру 20°С и относительную влажность 20%. Сколько нужно испарить в этой комнате воды, чтобы относительная влажность достигла 50%? Известно, что при 20°С давление насыщающих паров воды равно 2330 Н/м2.
задача 382 При температуре t = 20°С и давлении р = 760 мм рт. cm ≈ 105 Н/м2 воздух имеет влажность 100%. На сколько процентов он легче сухого воздуха той же температуры и с тем же давлением? Молекулярная масса сухого воздуха равна 29 кг/кмоль, а давление насыщающего пара воды при 20°С, равно 2330 Н/м2.
задача 76 Колба объемом 100 см3 была заполнена при 100°С воздухом с относительной влажностью 40%. Как нужно изменить объем колбы, чтобы воздух внутри нее стал сухим при 20°С? Давление насыщающих паров воды при 20°С равно 2266 Н/м2.
задача В комнате объемом 120 м3 относительная влажность воздуха В = 60% при температуре 15°С. Определить массу паров воды, находящихся в комнате. Плотность D насыщающих паров воды при 15°С равна 12,8 г/м3.
задача Сосуд с малым отверстием, содержащий небольшое количество воды, находится при температуре 76°С и атмосферном давлении 750 мм рт. ст. Через некоторое время сосуд закупорили и погрузили в жидкий воздух, кипевший при температуре 80° К. Каково теперь давление в сосуде? Давление насыщающих паров воды при температуре 76°С равно 300 мм рт. ст. Давлением насыщающего пара льда при температуре 80°К можно пренебречь.
задача Найти плотность ρ насыщенного водяного пара в воздухе при температуре T=300 К. Давление р насыщенного водяного пара при этой температуре равно 3,55 кПа.