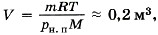
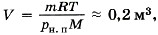
Przykład 1Oblicz ciśnienie osmotyczne roztworów.
Obliczyć ciśnienie osmotyczne roztworu zawierającego 1,4 litra 63 g glukozy C6H12O6 w 0 ° C.
Rozwiązanie: Ciśnienie osmotyczne roztworu określa się zgodnie z prawem Vant-Hoffa:
π oc m = nRT/ V,
gdzie n- ilość substancji rozpuszczonej, mol;
V oznacza objętość roztworu, m 3;
R - stała gazu molowego równa 8,3144 J / (mol-K).
Roztwór 1,4 l zawiera 63 g glukozy, której masa molowa wynosi 180 g / mol. W związku z tym zawiera 1,4 litra roztworu
n = 63/180 = 0,35 mol glukozy.
Ciśnienie osmotyczne tego roztworu glukozy:
Przykład 2 Oznaczanie masy cząsteczkowej nieelektrolitu za pomocą ciśnienia osmotycznego roztworu.
Oblicz masę cząsteczkową nieelektrolitów, jeśli 5 litrów roztworu zawiera 2,5 g nieelektrolitów. Ciśnienie osmotyczne tego roztworu wynosi 0,23 ± 105 Pa w 20 ° C.
Rozwiązanie:Wymiana nprzez wyrażenie m/ M, gdzie t- masa substancji rozpuszczonej, oraz M- otrzymujemy masę molową
π oc m = mRT/(MV).
W związku z tym masa molowa substancji rozpuszczonej jest
W związku z tym masa cząsteczkowa nieelektrolitów wynosi 52,96.
Rosma kPa: R = 8,31 J / mol ∙ K;
Różnica mm Hg Art.: R = 62,32 l ∙ mm Hg / deg. ∙ mol;
Rosm. atm.: R = 0,082 l ∙ atm ../ stopni ∙ mol;
Obliczyć ciśnienie osmotyczne roztworu zawierającego 90,08 g glukozy C6H 12 O 6 w 4 litrach roztworu o temperaturze 27 ° C Odpowiedź: 3.12 10 5 Pa.
Znajdź ciśnienie osmotyczne przy 0 0 С dla roztworu zawierającego 18,4 g gliceryny C 3 H 8 O 3 w 1 litrze. Odpowiedź: 4,54 ∙ 10 5 Pa.
Obliczyć ciśnienie osmotyczne roztworu nieelektrolitu zawierającego 1,52 ∙ 10 23 cząsteczek w 0,5 l roztworu o temperaturze 0 ° C i 30 ° C.
Odpowiedź: 11.35 ∙ 10 5 Pa; 12,60 ∙ 10 5 Pa.
W 1 litrze roztworu o temperaturze 25 ° C zawiera 6,84 g cukru C12H 22 O 11 i 1/38 g alkoholu etylowego C 2 H 5 OH. Jakie jest ciśnienie osmotyczne roztworu? Odpowiedź: 12,39 ∙ 10 4 Pa.
W 0 ° C ciśnienie osmotyczne roztworu cukru wynosi C12H22O 11 i jest równe 3,55 × 105 Pa. Ile gramów cukru znajduje się w 1 litrze roztworu? Odpowiedź: 53,53 g.
Ciśnienie osmotyczne roztworu zawierającego 3,2 litra nieelektrolitu w 1 l wynosi 2,42 ∙ 10 5 Pa w 20 ° C. Oblicz masę cząsteczkową nieelektrolitów. Odpowiedź: 32.2.
0,5 l roztworu zawiera 2 g nieelektrolitów, a roztwór w 0 0 С ma ciśnienie osmotyczne 0,51 ∙ 10 5 Pa. Jaka jest masa cząsteczkowa nieelektrolitów? Odpowiedź: 178.
Znajdź wzór substancji (mannit) zawierający 39,56% węgla, 7,69% wodoru i 52,75% tlenu, jeśli ciśnienie osmotyczne roztworu zawierającego 1 l 72 g mannitolu wynosi 9,00 10 5 Pa w 0 0 С Odpowiedź: C 6 H 14 O 6 .
Roztwór Aniliny C6H5NH2 ma takie samo ciśnienie osmotyczne jak roztwór zawierający 3,2 g CH3OH w 1 litrze wody o temperaturze 18 ° C. Ile gramów aniliny znajduje się w 1 litrze roztworu? Odpowiedź: 9.30
W jakiej temperaturze ciśnienie osmotyczne roztworu zawierającego 45 g glukozy C6H 12 O 6 w 1 l osiąga 607,8 kPa? Odpowiedź: 19,5 0 C.
Obliczyć ciśnienie osmotyczne 25% roztworu cukru C12H22O11 w temperaturze 15 ° C (gęstość 1,105 g / ml). Odpowiedź: 1935 kPa.
Ile gramów glukozy С 6 H 12 О 6 znajduje się w 200 ml roztworu, którego ciśnienie osmotyczne w 37 0 C wynosi 810,4 kPa? Odpowiedź: 11,3g.
Ciśnienie osmotyczne roztworu, w 250 ml, z którego zawarty jest 0,66 mocznika, wynosi 111,1 kPa w 33 ° C. Obliczyć masę cząsteczkową mocznika. Odpowiedź brzmi 60.3.
Ile cząsteczek substancji rozpuszczonej znajduje się w 1 ml roztworu, którego ciśnienie osmotyczne w 54 ° C wynosi 6065 Pa? Odpowiedź: 1,34 ∙ 10 18.
Roztwór 1 mm3 zawiera 10 15 cząsteczek substancji rozpuszczonej. Obliczyć ciśnienie osmotyczne roztworu w 0 ° C. Jaka jest objętość roztworu zawierającego 1 mol substancji rozpuszczonej? Odpowiedź: 3772 Pa; 602 l.
Z 342 g cukru C12H22O11 i wody przygotowano 22,4 litra roztworu. Jakie jest ciśnienie osmotyczne w 0 0 С?
Obliczyć ciśnienie osmotyczne 5% roztworu acetonu (CH3) 2CO w wodzie w 0 ° C. Gęstość roztworu wynosi 0,90 g / ml. Odpowiedź: 19 atm.
Obliczyć ciśnienie osmotyczne roztworu przy 17 0 С, jeśli 1 litr zawiera 18,4 g gliceryny C 3 H 8 O 3. Odpowiedź: 4, 76 atm .
Stwierdzono eksperymentalnie, że ciśnienie osmotyczne roztworu zawierającego 5 g hemoglobiny (białko we krwi) na 100 ml roztworu w 27 ° C wynosi 13,65 mm Hg. Obliczyć masę cząsteczkową hemoglobiny. Odpowiedź: ~ 68500.
7 litrów roztworu zawiera 24,4 g nieelektrolitów. Ciśnienie osmotyczne roztworu przy 0 0 С wynosi 1,3 atm. Oblicz masę cząsteczkową nieelektrolitów. Odpowiedź brzmi 60.
Roztwór cukru C12H12O 11 w 0 ° C ma ciśnienie osmotyczne 144 mm Hg. Ile gramów cukru znajduje się w 1 l tego roztworu? Odpowiedź: 2,3 roku
Ciśnienie osmotyczne roztworu glukozy C6H12O6 w 0 ° C wynosi 4,48 atm. Jaka jest moliwość takiego rozwiązania? Ile gramów glukozy zawiera 1 litr tego roztworu? Odpowiedź: 0,2 mol / l; 36g.
40 ml roztworu zawierającego 0,2 g substancji rozpuszczonej w 27,3 ° C wykazuje ciśnienie osmotyczne 1,2 atm. Oblicz masę cząsteczkową substancji rozpuszczonej. Odpowiedź jest 102,75.
Ekspres w mm Hg. ciśnienie osmotyczne roztworu w 0 ° C, zawierające 6,02 10 17 cząsteczek substancji rozpuszczonych w 1 ml roztworu. Odpowiedź: 680 mm Hg
Ekspres w mm Hg. ciśnienie osmotyczne roztworu w 10 ° C, zawierające 0,736 g gliceryny C 3 H 8 0 3 w 400 ml roztworu. Odpowiedź: 553 mm Hg
Obliczyć stężenie molowe roztworu, którego ciśnienie osmotyczne przy 0 0 С wynosi 1,12 atm. Odpowiedź: 0,05 mol / l.
W 0 ° C ciśnienie osmotyczne roztworu zawierającego 0,550 g hydrochinonu w 500 ml roztworu wynosi 170,2 mm Hg. Oblicz masę cząsteczkową substancji rozpuszczonej. Odpowiedź: 110.
W 0 ° C ciśnienie osmotyczne roztworu zawierającego 3,04 g difenyloaminy w 600 ml roztworu wynosi 510,7 mm Hg. Oblicz masę molową difenyloaminy. Odpowiedź: 169.
Ile wody należy dodać do 5 litrów roztworu cukru C12H22O11 w celu obniżenia ciśnienia osmotycznego z 10,13 ∙ 10 5 do 1,013 ∙ 10 5 Pa? Odpowiedź: 45 l.
Ile razy ciśnienie osmotyczne roztworu o stężeniu 0,1 mol / l wzrośnie po ogrzaniu od 7 do 47 ° C? Odpowiedź: 1,14 razy.
« Fizyka - klasa 10
Przy rozwiązywaniu problemów należy pamiętać, że ciśnienie i gęstość pary nasyconej nie zależą od jej objętości, ale zależą tylko od temperatury. Równanie stanu gazu doskonałego ma w przybliżeniu zastosowanie do opisu pary nasyconej. Ale podczas kompresji lub ogrzewania pary nasyconej jego masa nie pozostaje stała.
Rozwiązując niektóre problemy, możesz potrzebować wartości nasyconej prężności par w określonych temperaturach. Te dane muszą zostać pobrane z tabeli.
Zadanie 1.
Zamknięte naczynie o objętości V 1 = 0,5 m3 zawiera wodę o masie m = 0,5 kg. Naczynie ogrzano do temperatury t = 147 ° C. Jaką objętość należy zmienić, aby zawierała tylko parę nasyconą? Nasycone prężności par p n. n w temperaturze t = 147 ° C jest równe 4,7 10 5 Pa.
Rush
Para nasycona pod ciśnieniem p n. n zajmuje objętość równą ![]() gdzie M = 0,018 kg / mol to masa molowa wody. Objętość naczynia to V 1\u003e V, co oznacza, że para wodna nie jest nasycona. W celu nasycenia pary objętość naczynia powinna zostać zmniejszona o
gdzie M = 0,018 kg / mol to masa molowa wody. Objętość naczynia to V 1\u003e V, co oznacza, że para wodna nie jest nasycona. W celu nasycenia pary objętość naczynia powinna zostać zmniejszona o
Zadanie 2.
Wilgotność względna powietrza w zamkniętym naczyniu w t1 = 5 ° C wynosi φ 1 = 84%, aw t 2 = 22 ° C wynosi φ 2 = 30%. Ile razy ciśnienie pary nasyconej wody w temperaturze t 2 jest wyższe niż w temperaturze t 1?
Rush
Ciśnienie pary wodnej w naczyniu w T1 = 278 K jest równe ![]() gdzie r n. n1 - ciśnienie pary nasyconej w temperaturze t 1. W temperaturze T2 = 295 K ciśnienia
gdzie r n. n1 - ciśnienie pary nasyconej w temperaturze t 1. W temperaturze T2 = 295 K ciśnienia ![]()
Ponieważ wielkość jest stała, to zgodnie z prawem Charlesa
Stąd ![]()
Zadanie 3.
W pomieszczeniu o objętości 40 m 3 temperatura powietrza wynosi 20 ° С, a wilgotność względna φ 1 = 20%. Ile wody należy odparować, aby wilgotność względna φ 2 osiągnęła 50%? Wiadomo, że przy 20 ° С ciśnienie pary nasycającej p n = 2330 Pa.
Rush
Względna wilgotność ![]() stąd
stąd
Prężność pary przy wilgotności względnej φ 1 i φ 2
Gęstość jest związana z ciśnieniem przez równość ρ = Mp / RT, skąd
Masa wody w pomieszczeniu o wilgotności φ 1 i φ 2
Masę wody do odparowania:
Zadanie 4.
W pomieszczeniu z zamkniętymi oknami o temperaturze 15 ° С, wilgotność względna φ = 10%. Jaka będzie wilgotność względna, jeśli temperatura w pomieszczeniu wzrośnie o 10 ° C? Nasycona prężność par przy 15 ° Cn. n1 = 12,8 mm Hg Art., I w 25 ° C p n n2 = 23,8 mm Hg. Art.
Ponieważ para jest nienasycona, cząstkowe ciśnienie pary zmienia się zgodnie z prawem Charlesa p 1 / T 1 = p 2 / T 2. Z tego równania można określić ciśnienie nienasyconej pary p 2 w T 2: p 2 = p 1 T 2 / T 1. Wilgotność względna w T 1 jest równa:
Względna wilgotność w T 2 = 25 ° С jest równa:
Z równania (1) otrzymujemy zatem ![]()
Zadanie 5.
Względna wilgotność w pomieszczeniu 60% temperatura 18 ° C. Do jakiej temperatury powinien być ochładzany metalowy obiekt, aby jego powierzchnia była spocona?
Rush
Względna wilgotność powietrza φ = (r / r n p) 100%.
Do kondensacji pary konieczne jest jej nasycenie, to znaczy temperatura osiągnęła punkt rosy. Prężność par w temperaturze 18 ° C powinna być równa nasyconej prężności par w pożądanej temperaturze:
Nasycone prężności par p n p = 1,23 10 4 Pa w temperaturze t 2 = 10 ° С (określone zgodnie z tabelą). Dlatego t 2 ≈ 10 ° С.
Nasycone ciśnienie pary
1. Oznaczyć ciśnienie nasyconej pary wodnej w 25 ° С powyżej wodnego roztworu sacharozy, którego molowość wynosi 0,2, wiedząc, że ciśnienie nasyconej pary czystej wody przy 25 ° С wynosi 3167 Pa.
Odpowiedź: P = 3156 Pa.
2. W temperaturze 70 ° C, nasycona prężność par czystego benzenu wynosi 72968 Pa, czysty toluen - 26927 Pa. Oznaczyć całkowite ciśnienie pary i ciśnienie pary cząstkowej, zrównoważone w temperaturze 70 ° C ciekłą mieszaniną benzenu i toluenu. Udział molowy toluenu w fazie ciekłej NW (C6H5CH3) = 0,2.
Odpowiedź: P = 63759 Pa, P (C6H6) = 58374 Pa, P (C6H5CH3) = 5385 Pa.
3. Obliczyć prężność par ponad 2% (wagowo) wodnego roztworu sacharozy (C12H22O11) w 373K. Rozważyć to rozwiązanie, aby przestrzegać praw skrajnie rozcieńczonych roztworów. Ciśnienie pary czystego rozpuszczalnika przy 373 KP ° = 1013 hPa.
Odpowiedź: P = 1012 hPa.
4. W temperaturze 298 K ciśnienie pary wodnej wynosi 23,76 Torr, a ciśnienie pary wody morskiej wynosi 22,98 tora. Biorąc pod uwagę, że woda morska ze wszystkich soli zawiera tylko chlorek sodu, należy oszacować stężenie soli w molach.
Odpowiedź: C ml (NaCl) = 0,93.
5. Prężność pary czystej wody w temperaturze 313 K jest równa 7375.4 Pa. W tej temperaturze obliczyć prężność pary nad roztworem zawierającym 0,9206 × 10 -2 kg glicerolu w 0,36 kg wody. Wzór gliceryny: CH 2 OH-CHOH-CH 2OH.
Odpowiedź: P = 7338,7 Pa.
6. 0,1 kg eteru (M = 74) zawiera 0,01 kg nielotnej substancji. Prężność par tego roztworu wynosi 426 Torr w 293 K, a prężność par czystego eteru w 293 K wynosi 442 Torr. Oblicz masę molową substancji rozpuszczonej.
Odpowiedź: M = 197,2.
2. Obniżenie temperatury krzepnięcia i podniesienie temperatury wrzenia
7. W wodnym roztworze alkoholu etylowego ułamek molowy alkoholu wynosi 0,042. Oznaczyć temperaturę zamarzania tego roztworu przy P = 1 atm.
Odpowiedź: t s = -4,54 ° C
8. 55,16 g sacharozy rozpuszczono w 316,3 g wody. Oblicz temperaturę wrzenia i temperaturę krzepnięcia tego roztworu.
Odpowiedź: T = 373,41 K; T C = 272,2 K.
9. Szeroko stosowany środek przeciw zamarzaniu do chłodnic samochodowych zawiera glikol etylenowy (CH 2 OH - CH 2 OH). Ile tej substancji należy dodać do wody chłodnicy o łącznej objętości 7,5 litra, jeśli weźmiemy najniższą temperaturę roboczą -20 ° С. Gęstość glikolu etylenowego 1110.
Odpowiedź: m (CH 2OH - CH 2OH) = 3125 g.
10. Glicerol CH 2OH-CHOH-CH 2OH jest zwykle dodawany do bardzo słabych wodnych roztworów, aby zapobiec zamarzaniu w zimie. Zakładając, że prawo Raula stosuje się do roztworów o takiej koncentracji, obliczyć, ile gliceryny należy dodać, aby roztwór zawierający 0,1 kg wody nie zamarzł do 268,16 K.
Odpowiedź: m (CH 2OH-CHON-CH 2OH) = 24,75 g.
11. 10 mg materii organicznej rozpuszczonej w 1 g kamfory. Obniżenie temperatury zamrożenia kamfory wyniosło 1,33 K; Kamromorficzna stała 40. Oblicz masę molową substancji rozpuszczonej.
Odpowiedź: M = 301.
12. 0,0106 kg roztworu zawiera 0,4 × 10-3 kg kwasu salicylowego rozpuszczonego w alkoholu etylowym. Roztwór ten wrze w temperaturze 0,337 K powyżej temperatury wrzenia czystego alkoholu. Oznaczyć masę molową kwasu salicylowego, biorąc pod uwagę, że stała ebulioskopowa etanolu wynosi 1,19.
Odpowiedź: M = 138,6.
13. Obliczyć temperaturę krzepnięcia wodnego roztworu mocznika, jeśli jego frakcja molowa w roztworze wynosi 0,0032, a ciepło topnienia lodu wynosi D m H ° = 6010. Rozważ rozwiązanie jako bardzo rozcieńczone.
Odpowiedź: T C = 272,82 K.
14. Obliczyć temperaturę krzepnięcia roztworu zawierającego 5 g nikotyny C10H14N2 w 250 g etanolu. Temperatura krzepnięcia czystego etanolu wynosi 156 K, a ciepło topnienia etanolu wynosi D m H ° = 5,02 × 10 3.
Odpowiedź: T s = 155,77 K.
15. Temperatura wrzenia benzenu wynosi 353,36 K, a ciepło wrzenia 30795. Oblicz stałą ebuliometryczną benzenu.
Odpowiedź: E = 2,629.
Ciśnienie osmotyczne
16. Obliczyć ciśnienie osmotyczne wodnego roztworu sacharozy (C12H22O11) i ciśnienie pary nasyconej powyżej roztworu zgodnie z poniższymi danymi. Temperatura roztworu 293 K; na 100 g roztworu znajduje się 6,84 g sacharozy; ciśnienie nasyconej pary czystej wody przy 293 K P ° = 23,38 hPa.
Odpowiedź: P = 487 kPa; P = 23,3 hPa.
17. California Sequoia to najwyższe drzewo na świecie. Biorąc pod uwagę, że jego wysokość wynosi 105,4 m, należy oszacować ciśnienie osmotyczne konieczne do podniesienia wody z korzeni do góry.
Odpowiedź: P = 10,2 atm.
18. Jeśli rura z półprzepuszczalną membraną na jednym końcu umieszczona jest w wodzie morskiej na wystarczającej głębokości, ciśnienie hydrostatyczne wody powinno doprowadzić do odwróconej osmozy - świeża woda wpadnie do rury. Woda morska ma ciśnienie osmotyczne 23 atmosfery i gęstość 1,03. Jak głęboko należy obniżyć rurę do odwróconej osmozy?
Odpowiedź: h = 235 m.
19. 20 mg białka rozpuszczonego w 10 g wody. W temperaturze 25 ° C ciśnienie osmotyczne roztworu wynosi 0,3 tora. Określ masę molową białka, biorąc pod uwagę idealne rozwiązanie.
Odpowiedź: M = 1,24 × 10 5.
D. Roztwory elektrolitów
Nasycone ciśnienie pary wodnej
Rozwiązanie zadania 127 Korzystając z tabeli ciśnień nasyconej pary wodnej, określ ciśnienie pary nasyconej, jeśli woda wrze w temperaturze 60 ° C.
Rozwiązanie zadania 128 Woda gotowana w temperaturze 160 ° C Korzystając z tabeli ciśnień nasyconej pary wodnej, określ ciśnienie zewnętrzne nad wodą.
Problem z roztworem 129 W jakiej temperaturze gotuje się woda, jeśli ciśnienie zewnętrzne nad powierzchnią wynosi 76 kPa? Podczas rozwiązywania problemów użyj tabel ciśnień nasyconej pary wodnej.
Problem z rozwiązaniem 134 Wilgotność względna powietrza przy 20 ° С wynosi 58%. Na co maksymalna temperatura czy rosa wypadnie? Gęstość pary nasycającej wynosi 17,3 ± 10-3 kg / m3 przy 20 ° С.
Rozwiązanie problemu 135 Ciśnienie nienasyconej pary wodnej w temperaturze 300 K wynosi 1,5 kPa. Określ stężenie cząsteczek.
Rozwiązanie problemu 136 W temperaturze 300 K ciśnienie nasyconej pary wodnej wynosi 3 · 104 Pa. Para została oddzielona od cieczy i ogrzewana ze stałą objętością do 350 K. Wyznacz ciśnienie pary w tej temperaturze.
Rozwiązanie Problem Masa m = 40 g cukru (C12H22O11) rozpuszczonego w objętości V = 0,5 l wody. Temperatura roztworu t = 50 ° C Znajdź ciśnienie nasyconej pary wodnej powyżej roztworu.
zadaniem jest znalezienie ciśnienia pary powyżej roztworu w temperaturze 60 ° С, jeśli prężność par nad tym samym roztworem w temperaturze 30 ° С wynosi 4,2 kPa.
wyzwanie Nasycona prężność par powyżej roztworu jest mniejsza niż nasycona prężność par 1,02 razy. Oblicz liczbę N cząsteczek wody na jedną cząsteczkę substancji rozpuszczonej?
zadanie Nielotna substancja ważąca 100 g została rozpuszczona w wodzie o pojemności 1 litra. Temperatura roztworu wynosi 90 ° C. Prężność pary nad roztworem tej substancji wynosi 68,8 kPa. Znajdź masę molową rozpuszczanej substancji.
zadanie Nielotna substancja, której masa molowa μ = 60 g / mol, została rozpuszczona w wodzie. Temperatura roztworu 80 ° C Nasycona prężność par nad roztworem 47,1 kPa. Znajdź ciśnienie osmotyczne p0 roztworu.
problem W uszczelnionej rurze o objętości V = 0,4 l występuje para wodna pod ciśnieniem rp = 8,5 kPa w temperaturze Tp = 423 K. Ile rosy spada na ścianki rury, gdy woda jest schładzana do temperatury Tnp = 295 K? Ciśnienie nasycającej pary wodnej w temperaturze 295 K jest równe pH, N = 2,6 kPa.
Zadanie Wilgotne powietrze o objętości 1 m przy wilgotności względnej φ = 60%, temperaturze T = 293 K i normalnym ciśnieniu atmosferycznym ma masę m = 12004 kg. Oznaczyć ciśnienie nasycającej się pary wodnej w temperaturze T.
zadanie Naczynie jest powietrzem o temperaturze T1 = 283 K i wilgotności φ = 60%. Jak zmieni się wilgotność powietrza i jego ciśnienie, jeśli powietrze zostanie ogrzane do temperatury T2 = 373 K, a objętość zostanie zmniejszona trzykrotnie? Początkowe ciśnienie suchego powietrza wynosi p1 = 38,5 kPa, ciśnienie nasycającej pary wodnej w 283 K jest równe p1n = 1,2 kPa.
zadanie Wilgotność względna powietrza w zamkniętym naczyniu w temperaturze t1 = 20 ° С wynosi φ1 = 0,3. Określ względną wilgotność powietrza w t2 = 8 ° С. W t1, ciśnienie nasyconej pary wodnej, pH 1 = 2,33 kPa, w t2, jest równe pH2 = 1,07 kPa.
zadanie Suche powietrze wypełnia zamknięte naczynie objętością V = 25 l przy ciśnieniu p1 = 105 Pa i temperaturze t1 = -23 ° С. Kawał lodu o masie t = 9 g wkłada się do naczynia i naczynie ogrzewa się do temperatury t2 = 127 ° C. Określ ciśnienie wilgotnego powietrza w naczyniu. Ciśnienie nasyconej pary wodnej w temperaturze t = 127 ° C jest równe pH = 250 kPa. Masa molowa wody wynosi p = 18 · 10-3 kg / mol.
zadanie W izolowanym termicznie naczyniu podzielonym przez przegrodę na pół, mamy nasyconą parę wodną: po lewej stronie - w temperaturze t1 = 20 ° С, aw prawej części - w t2 = 50 ° С. Jaka będzie gęstość, temperatura i prężność par w naczyniu równe, jeśli usunięto przegrodę? Czy ta para będzie nasycona?
zadanie W temperaturze = 3 ° С, ciśnienie nasyconej pary wodnej p0 = 5,945 Pa Wilgotne powietrze w tej temperaturze, w odniesieniu do wilgotności φ = 8% i ciśnienia p = 101, kPa zajmuje objętość = 1 m3. Określ jego masę.
zadanie Wieczorem temperatura powietrza wynosiła t1 = 16 ° С, wilgotność względna 65%. W nocy temperatura powietrza spadła do t2 = 4 ° С. Czy była rosa? W temperaturze 16 ° С gęstość nasyconej pary wodnej wynosi p01 = 13,6 g / m3, a przy 4 ° С - p02 = 6,4 g / m3.
zadaniem jest znalezienie bezwzględnej i względnej wilgotności powietrza w pomieszczeniu o temperaturze t1 = 20 ° С, jeśli punkt rosy wynosi t2 = 9 ° С. Jak zmienia się wilgotność względna, gdy temperatura spadnie do t3 = 16 ° С, jeśli wilgotność bezwzględna pozostanie taka sama? Gęstości nasyconej pary wodnej w temperaturach t1, t2 i t3 wynoszą odpowiednio: p01 = 17,3 · 10-3 kg / m3, p02 = 8,8 · 10-3 kg / m3, p03 = 13,6 · 10-3 kg / m3.
zadanie obliczyć w temperaturze 100 ° C gęstość nasycającej pary wodnej?
tabele zadań pokazują, że jeśli ciśnienie pary nasycającej jest wyrażone w mmHg. Art., A jego gęstość - w g / m3, a następnie w temperaturach niewiele różniących się od temperatury pokojowej, wartości te są zbliżone do siebie. Udowodnij to. (Użyj rozwiązania zadania 304.)
challenge Air ma temperaturę 60 ° C i bezwzględną wilgotność 50 g / m3. Jaka będzie bezwzględna wilgotność tego powietrza, jeśli temperatura spadnie do 10 ° C? Wiadomo, że przy 10 ° C ciśnienie pary nasycającej wynosi 1230 N / m2.
problem W pomieszczeniu o objętości 40 m3 powietrze ma temperaturę 20 ° C i wilgotność względną 20%. Ile wody należy odparować w tym pomieszczeniu, aby wilgotność względna osiągnęła 50%? Wiadomo, że przy 20 ° C ciśnienie nasyconej pary wodnej wynosi 2330 N / m2.
problem 382 W temperaturze t = 20 ° C i ciśnieniu p = 760 mm Hg. cm ≈ 105 N / m2 Powietrze ma wilgotność 100%. O ile procent jest lżejszy od suchego powietrza o tej samej temperaturze i przy takim samym ciśnieniu? Masa cząsteczkowa suchego powietrza wynosi 29 kg / kmol, a ciśnienie nasycającej pary wodnej w 20 ° С wynosi 2330 N / m2.
zadanie 76 Kolbę o pojemności 100 cm3 napełniono w temperaturze 100 ° С powietrzem o wilgotności względnej 40%. Jak zmienić objętość kolby, aby powietrze wewnątrz wyschło w temperaturze 20 ° C? Ciśnienie nasycającej pary wodnej w 20 ° С wynosi 2266 N / m2.
zadanie W pomieszczeniu o objętości 120 m3, względna wilgotność powietrza B = 60% w temperaturze 15 ° C Oznaczyć masę pary wodnej w pomieszczeniu. Gęstość D nasyconej pary wodnej w 15 ° С wynosi 12,8 g / m3.
zadanie Naczynie z małym otworem zawierającym niewielką ilość wody ma temperaturę 76 ° C i ciśnienie atmosferyczne 750 mm Hg. Art. Po pewnym czasie naczynie zamknięto i zanurzono w ciekłym powietrzu wrzącym o temperaturze 80 ° K. Jakie jest teraz ciśnienie w naczyniu? Ciśnienie nasycającej pary wodnej w temperaturze 76 ° C wynosi 300 mm Hg. Art. Ciśnienie nasycającej się pary lodu o temperaturze 80 ° K może być zaniedbane.
zadaniem jest znalezienie gęstości ρ nasyconej pary wodnej w powietrzu w temperaturze T = 300 K. Ciśnienie p nasyconej pary wodnej w tej temperaturze wynosi 3,55 kPa.